A cigarrinha-do-milho, Dalbulus maidis (Delong & Wolcott) (Hemiptera: Cicadellidae) é um inseto pequeno de coloração amarelo-palha, com comprimento variando entre 3,7 e 4,3 mm, porém, são facilmente visualizados no cartucho das plantas de milho. Essa espécie é citada como a única representante do gênero no Brasil e considerada uma das pragas mais importantes da atualidade por ser vetor de três doenças sistêmicas: enfezamento pálido e vermelho, causadas por um grupo de bactérias da classe Mollicutes, Spiroplasma Kunkelii (CSS-corn stunt spiroplasma) e fitoplasma (MBSP- maize bushy stunt phytoplasma), respectivamente; e risca do milho ou raiado fino, cujo agente causal é um vírus (MRFV-maize rayado fino vírus) (WAQUIL et al., 2002; OLIVEIRA, 1996; 2003).

Figura 1. Cigarrinha-do-milho (D. maidis) (SCHNEIDER, 2017).
Ambiente e influência
Com a quebra da sazonalidade de plantio da cultura em virtude da maior intensificação do cultivo de segunda safra e de sistemas irrigados, gerou-se uma maior pressão de pragas e doenças no milho. Em especial a cigarrinha, que possui uma alta capacidade de migração a longas distâncias, o que favorece sua disseminação e colonização em diferentes áreas e ocorrência em praticamente todas as fases da cultura. Altas populações com dinâmica de migração de lavouras com plantas adultas infectadas para lavouras com plantas jovens sadias pode disseminar a infecção em áreas superiores a 100 hectares (OLIVEIRA, 2003).
O inseto se alimenta da seiva da planta através da introdução do seu estilete nos tecidos do floema da planta, caracterizando o dano direto, e, indiretamente, por meio da saliva, injeta toxinas e transmite fitopatógenos alojados na sua glândula salivar. Na fase inicial da cultura, a alta densidade populacional da cigarrinha pode ocasionar seca e morte das plantas, devido a intensa sucção da seiva, a ampla quantidade de ovos depositados no limbo foliar, a ação tóxica da sua saliva e a excreção de honeydew que propicia o desenvolvimento de fungos sobre as folhas “fumagina” (BUSHING & BYRTON, 1974; NAULT et al.,1983; MARÍN, 1987; OLIVEIRA, 2003).
A transmissão de patógenos é o principal problema do ataque dessa praga na cultura do milho, no qual esses patógenos se multiplicam na planta em um período latente, sem desenvolvimento de sintomas, por três a quatro semanas. Após a infecção, a transmissão ocorre rapidamente, porém, os sintomas só são visualizados 30 dias após a semeadura, para o vírus da risca do milho, e no caso dos enfezamentos os sintomas e efeitos prejudiciais se manifestam na fase de produção. Portanto, a principal estratégia de redução na incidência dessas doenças é o controle da população de cigarrinhas (OLIVEIRA, 2003).
A incidência de enfezamentos tem aumentado significativamente na cultura do milho, prejudicando a formação e enchimento de grãos, gerando prejuízos severos (OLIVEIRA, 2003). Os sintomas do enfezamento pálido são caracterizados por listras largas descoloridas amarelas ou verde limão na base das folhas infectadas e nas folhas novas. Além disso, as plantas também podem apresentar encurtamento de entrenós, espigas e bonecas pouco desenvolvidas ou deformadas, e em alguns casos a planta pode não formar espigas ou apresentar nenhum desses sintomas por ocorrer uma infecção branda. Quanto ao enfezamento vermelho, as plantas exibem avermelhamento nas folhas mais velhas, encurtamento de entrenós, perfilhamento anormal e desenvolvimento de várias gemas florais (WAQUIL, 2004).
Os principais fatores que favorecem a incidência e os danos por enfezamentos são: condições climáticas com temperaturas elevadas, acima de 17 °C à noite e de 27 °C durante o dia; grande quantidade de lavouras de milho em diferentes fases de crescimento, favorecendo a sobreposição do ciclo da planta; tigueras, plantas de milho remanescentes do cultivo anterior; e a suscetibilidade das cultivares de milho que podem beneficiar a multiplicação dos agentes patogênicos nas plantas (WAQUIL, 2004).
Manejo integrado da cigarrinha-do-milho
Uma das formas de manejo e controle da cigarrinha é a eliminação de tigueras na entressafra e no cultivo da soja, visando acabar com as fontes de alimento e reprodução da praga. Outra estratégia seria o controle cultural, planejando o plantio afim de não implementar próximo a lavouras mais velhas, evitar semeadura em áreas próximas a lavouras com enfezamentos e evitar plantios tardios e sucessivos de milho. No caso de plantios tardios, observa-se uma maior incidência de enfezamentos e queda na produção, pois as cigarrinhas tendem a migrar para estas áreas (Gráfico 1).
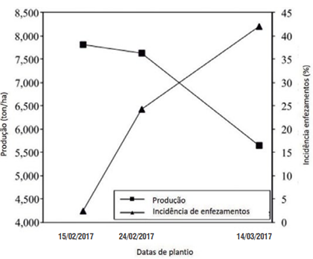
Gráfico 1. Efeito da data de plantio na incidência de enfezamentos e produção de grãos em milho no estado do Tocantins, safrinha 2017.
Em relação ao manejo químico, é recomendado o tratamento de sementes para melhorar o controle nos estádios iniciais da cultura, e posteriormente realizar a aplicação de inseticidas também na fase inicial de desenvolvimento do milho, sendo os 40 dias após a emergência o período mais crítico. Até então existem 54 produtos químicos registrados (AGROFIT, 2020) para o controle da cigarrinha-do-milho, tanto para tratamento de sementes quanto para pulverizações.
Controle biológico da cigarrinha-do-milho
Para reduzir o uso de defensivos químicos é essencial o uso de outras formas de controle que compõem o Manejo Integrado de Pragas (MIP). Dentre elas, para a cigarrinha-do-milho, o controle biológico por meio do uso de fungos entomopatogênicos é uma das principais estratégias. Atualmente, 16 produtos comerciais são registrados à base do fugo Beauveria bassiana para controle do inseto D. maidis. Quando posicionados de forma correta, que seria a aplicação nos estádios iniciais de desenvolvimento da cultura do milho, a eficiência de controle pode chegar a 85%.
Fungos entomopatogênicos têm ganhado bastante espaço no mercado de inseticidas para cigarrinha-do-milho, por conta da eficiência de controle semelhante aos inseticidas químicos (TOLEDO et al. 2007; SILVA et al. 2009; SANDHU et al. 2012), como é o caso da Beauveria bassiana, microrganismo parasita que age por contato, infectando e eliminando insetos-praga. Seus conídios penetram via cutícula e aparelho respiratório (CLARK et al., 1968) e digestivo (BROOME et al., 1976), em seguida o fungo se multiplica na hemolinfa produzindo toxinas e consumindo os nutrientes ali presentes, eliminando o inseto por infecção generalizada (LAZZARINI, 2005). Após a colonização da parte interna do hospedeiro, em condições favoráveis, o fungo emerge e esporula sobre o corpo da praga, gerando inóculo que ao se dispersarem poderão iniciar a infecção de outros indivíduos da praga.
Outros fungos também têm apresentado bons resultados no controle da cigarrinha-do-milho, além da B. bassiana, como mostra o estudo de eficácia no controle do vetor em milho doce realizado por Ribeiro (2019). O trabalho evidenciou que o fungo Metarhizium anisopliae tem taxas de controles semelhantes ao observado com o uso da Beauveria bassiana e do inseticida químico Tiametoxam + Lambdacialotrina.
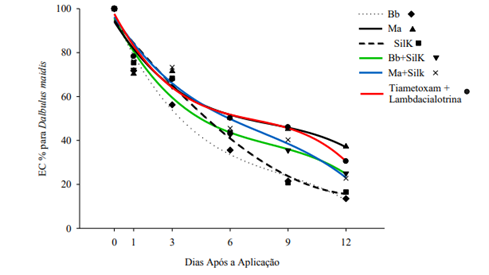
Gráfico 2. Análises de regressão para a Eficiência de Controle (EC %) (linhas: valores estimados e símbolos: valores observados) para Dalbulus maidis (DeLong & Wolcott) (Hemiptera: Cicadellidae) em função de cinco intervalos de dias após a aplicação dos tratamentos, de forma isolada ou sob mistura binária, segundo Ribeiro (2019). Bb (Beauveria bassiana), Ma (Metarhizium anisopliae), SilK (Silicato de Potássio), Bb+SilK (mistura binária) e Ma+SilK (mistura binária). Orizona, estado de Goiás, Brasil.
Bouveriz WP: aliado no controle de D. maidis
Pensando no combate desta difícil praga, a Biocontrol oferece em seu portfólio o inseticida microbiológico Bouveriz WP, sua formulação conta com o fungo entomopatogênico Beauveria bassiana IBCB 66. O controle deve ser iniciado logo nos estádios iniciais da cultura do milho, a fim de evitar as altas populações da praga, e consequentemente impedir que infectem as plantas e não ocasionem os enfezamentos. Bouveriz WP se destaca pelo maior poder de ação (Figura 2) e alta concentração, 8x10⁹ UFC/g, oferecendo ao produtor melhores resultados com menor dose por hectare.

Figura 2. D. maidis parasitada após aplicação do produto Bouveriz WP (Beauveria bassiana IBCB 66).
Referências
AGROFIT - MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO. Consulta de Pragas e doenças. Disponível em: Acesso em jan. 2021.
BROOME, J. R.; SIKOROWSKI, P. P.; NORMENT, B. R. A mechanism of pathogenicity of B. bassiana on the larvae of the imported fire ant, Solenops richteri. Journal of Invertebrate Pathology, v. 28, p. 87-91, 1976.
Bushing, R. W. & V. E. Burton. 1974. Leafhopper damage to silage corn in California. J. Econ. Entomol. 67: 656-658.
CLARK, T. B.; KELLEN, W. R.; FUKUDA, T.; LINDEGREN, J. E. Field and laboratory studies of the patogenicity of the fungus B. bassiana to three genera of mosquitoes. Journal of Invertebrate Pathology, v. 11, p. 1-7, 1968.
COTA, L.V.; OLIVEIRA, I.R.; SILVA, D.D.; MENDES, S.M.; COSTA, R.V.; SOUZA, I.R.P.; SILVA, A.F. Manejo da cigarrinha e enfezamentos na cultura do milho. EMBRAPA/FAERP/SENAR-PR. Disponível em: https://sistemafaep.org.br/wp-content/uploads/2021/02/Cartilha-cigarrinha-e-enfezamentos_WEB.pdf. Acesso em: 25 jan. 2022.
LAZZARINI, G. M. J. Efeito da umidade sobre a germinação in vitro de Beauveria bassiana e Metarhizium anisopliae e atividade contra Triatoma infestans. 2005. 46p. Dissertação (Mestrado em Parasitologia) - Instituto de Patologia Tropical e Saúde Pública, Universidade Federal de Goiás, Goiânia, 2005.
MANEIRA, Roberto. Ferramentas para o Controle da Cigarrinha-do-milho. Brasilia-DF. 2019.
Oliveira, C. M. 1996. Variações morfológicas entre populações de Dalbulus maidis (DeLong & Wolcott) (Homoptera: Cicadelidae) em algumas localidades do Brasil. Dissertação de mestrado, Departamento de Entomologia/ESALQ-USP, dez/96. 70p.
OLIVEIRA et al. Enfezamentos, viroses e insetos vetores em milho – Identificação e controle. Sete Lagoas: Embrapa Milho e Sorgo. p.65 (Embrapa Milho e Sorgo. Circular técnica, 26). 2003.
OLIVEIRA, CHARLES M. et al. Disseminação de molicutes do milho a longas distâncias por Dalbulus maidis (Hemiptera: Cicadellidae). Fitopatologia Brasileira [online]. 2002, v. 27, n. 1 [Acessado 26 Janeiro 2022], pp. 91-95. Disponível em:
RIBEIRO, J. M. Eficiência de controle da cigarrinha-do-milho por dois fungos entomopatógenos, associados com o indutor de resistência K2SiO3, em plantas de Zea mays (var. saccharata) sob condições de campo. Dissertação apresentada ao Instituto Federal Goiano. 31 p. Urutaí, 2019.
SANDHU, S. S.; SHARMA, A. K.; BENIWAL, V.; GOEL, G.; BATRA, P.; KUMAR, A.; JAGLAN, S.; SHARMA, A. K.; MALHOTRA, S. Myco-biocontrol of insect pests: factors involved, mechanism and regulation. Journal of Pathogens, Article, ID 126819, 10 pages, 2012.
SILVA, A. H.; TOSCANO, L. C.; MARUYAMA, W. I.; PEREIRA, M. F. A.; CARDOSO, S. M. Controle de Dalbulus maidis (Hemiptera: Cicadellidae) De Long & Wolcott (1923) por 24 Beauveria bassiana na cultura do milho. Boletin de Sanidad Vegetal Plagas, v. 35, n. 4, p. 657- 664, 2009.
TOLEDO, A. V.; ALIPPI, A. M.; LENICOV, A. M. M. R. Growth inhibition of Beauveria bassiana by bacteria isolated from the cuticular surface of the corn leafhopper, Dalbulus maidis and the planthopper, Delphacodes kuscheli, two important vectors of maize pathogens. Journal of Insect Science, v. 11, n. 29, 2011.
TORDIN, C. Embrapa mostra a importância do Manejo Integrado de Pragas na Agrishow. 2014. Disponível em:. Acesso em: 31/01/2022
WAQUIL, J. M.; VIANA, P. A.; CRUZ, I. Cultivo do milho: manejo integado de pragas (MIP). Sete Lagoas: Embrapa Milho e Sorgo. 16 p. (Embrapa Milho e Sorgo. Comunicado técnico, 50). 2002
Waquil, J.M. 2004. Cigarrinha-do-milho: vetor de molicutes e vírus. EMBRAPA Milho e Sorgo Circular técnica 41. Sete Lagoas, MG.



